QUIMICA
La prueba de química del examen de Estado - ICFES SABER 11° busca conocer la capacidad de los estudiantes para establecer relaciones entre conceptos de la química y de otras áreas del conocimiento, utilizando su capacidad crítica para identificar contradicciones en una argumentación y valorar la calidad de una información para asumir una posición propia. Ademas las 24 preguntasCOMPETENCIAS:
Uso comprensivo del conocimiento científico: Esta competencia está íntimamente relacionada con la capacidad para comprender y usar conceptos, teorías y modelos de las ciencias en la solución de problemas.
Explicación de fenómenos: Se relaciona con la capacidad para construir explicaciones, así como para comprender argumentos y modelos que den razón de los fenómenos. Esta competencia conlleva una actitud crítica y analítica en el estudiante que le permite establecer la validez o coherencia de una afrmación. Es posible explicar un mismo hecho utilizando representaciones conceptuales pertinentes de diferente grado de complejidad.
Indagación: Se refere a la capacidad para plantear preguntas y procedimientos adecuados, así como para buscar, seleccionar, organizar e interpretar información relevante para dar respuesta a esos interrogantes. El proceso de indagación en ciencias implica, entre otras cosas, observar detenidamente la situación, plantear preguntas, buscar relaciones de causa-efecto, hacer predicciones, plantear experimentos, identificar variables, realizar mediciones, además de organizar y analizar resultados.
COMPONENTES:
Aspectos analíticos de sustancias: Incluye aspectos relacionados con el análisis cualitativo y cuantitativo de las sustancias. En el primero se evalúan problemas en los que se pretende establecer cuáles son sus componentes y las características que permiten diferenciarlas; en el segundo se valoran situaciones en las que debe determinarse la cantidad de cada de cada uno de sus compuestos.
Aspectos físicoquímicos de sustancias: En éste se analizan la composición, la estructura y las características de las sustancias desde la teoría atómico-molecular y desde la termodinámica. El primer referente muestra cómo son los átomos, los iones o las moléculas, además de la forma como se relacionan con sus estructuras químicas; el segundo permite comprender las condiciones termodinámicas en las que hay mayor probabilidad de que un material cambie física o fsicoquímicamente.
____________________________________________________________________________________________
tomado de http://www.pasaralaunacional.com/2010/05/examen-quimica-y-fisica-tipo-icfes.html
Quimica
Responda las preguntas 1 a 3 de acuerdo a la siguiente información.
En la tierra cuando se enciende una vela se leva a cabo una reacción entre el oxigeno del aire y el material del que está hecha la vela.
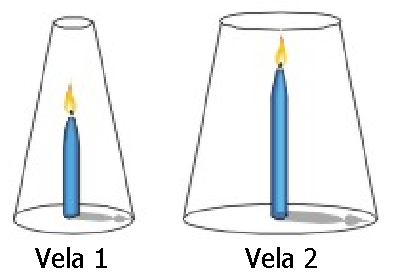
1. Se tienen dos velas encendidas de igual grosor en donde la longitud de la vela 2 es el doble en comparación al de la vela 1.
Si se coloca un recipiente angosto sobre la vela 1 y uno ancho sobre la vela 2, y no hay entrada ni salida de aire, como se muestra en la figura, al cabo de un tiempo:
A. La vela 2 se apaga primero
B. Las velas siguen encendidas hasta consumirse totalmente
C. Las velas se apagan al mismo tiempo
D. La vela 1 se apaga primero
B. Las velas siguen encendidas hasta consumirse totalmente
C. Las velas se apagan al mismo tiempo
D. La vela 1 se apaga primero
2. Si ahora se tienen las mismas velas pero en otro planeta en donde no hay atmósfera, probablemente:
A. Las velas se consuman al mismo tiempo
B. No se genere llama en las velas
C. La longitud de la vela 1 se hace igual a la de la vela 2
D. Se genere una gran explosión al encender las velas
B. No se genere llama en las velas
C. La longitud de la vela 1 se hace igual a la de la vela 2
D. Se genere una gran explosión al encender las velas
3. Las masas moleculares del Carbono, el Hidrógeno y el Oxígeno son 12, 1 y 16 (g/mol) respectivamente.
Suponga que la ecuación química (sin balancear) de la reacción es:
C3H8 + 5O2 --► 3CO2 + H2O
Es de esperar que finalizada la reacción se hayan formado respectivamente:
A. 132 g de CO2 y 72 g de H2O
B. 76 g de CO2 y 72 g de H2O
C. 3 g de CO2 y 4 g de H2O
D. 44 g de CO2 y 18 g de H2O
B. 76 g de CO2 y 72 g de H2O
C. 3 g de CO2 y 4 g de H2O
D. 44 g de CO2 y 18 g de H2O
4. En la etiqueta de un frasco de vinagre aparece la información: "Solución de ácido acético al 4% en peso".
El 4% en peso indica que el frasco contiene:
A. 4 g de ácido acético en 100 g de solución
B. 100 g de soluto y 4 g ácido acético
C. 100 g de solvente y 4 g de ácido acético
D. 4 g de ácido acético en 96 g de solución
B. 100 g de soluto y 4 g ácido acético
C. 100 g de solvente y 4 g de ácido acético
D. 4 g de ácido acético en 96 g de solución
5. Una mol de dióxido de carbono gaseoso (CO2) y una mol de agua gaseosa (H2O) tienen en común:
A. El volumen que ocupan
B. La masa presente
C. La clase de átomos
D. El número de partículas
B. La masa presente
C. La clase de átomos
D. El número de partículas
No hay comentarios:
Publicar un comentario